Abstract
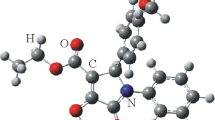
The title compound was prepared by acid catalyzed condensation of the appropriate pyrrole-2,5-dialdehyde and two equivalents of the corresponding pyrromethenone. Its solution structure was deduced by15N-,13C- and1H-NMR to be the bislactam form with a fixation as the N27-H-tautomer and configuration (4Z, 9Z, 15Z, 20Z) at the exocyclic double bonds. From NOE measurements and a comparison of its UV-VIS spectrum andPPP-SCF-LCAO-MO-CI spectra calculations an overall helical 5sp, 10sp, 14sp, 19sp-conformation with a dihedral angle of 20° at the exocyclic single bonds was deduced. Judging from spin—lattice relaxation times of the methyl groups its flexibility is lowered as compared to bilatrienes-abc. However, its helix interconversion barrier is still low enough to prohibit an identification of the enantiomeric helices, as shown by means of a chiral shift reagent.
Similar content being viewed by others
Literatur
63. Mitt.:Falk H., Müller N., Wansch S., Monatsh. Chem.116, 1087 (1985).
Für entsprechende Übersichten siehe:Dolphin D., The Porphyrins,I–VI. New York: Academic Press. 1979.
Bauer V. J., Clive D. L. J., Dolphin D., Paine IIIJ. B., Harris F. L., King M. M., Loder J., Wang S. C., Woodward R. B., J. Amer. Chem. Soc.105, 6429 (1983).
Gossauer A., Bull. Soc. Chim. Belg.92, 793 (1983);Rexhausen H., Gossauer A., J. Chem. Soc., Chem. Commun.1983, 275.
Fischer H., Reinecke H., Hoppe Seyler's Z. Physiol. Chem.251, 205 (1938).
Für lineare Polypyrrole als Ionophore siehe:Eichinger D., Falk H., Monatsh. Chem.113, 355 (1982).
Siedel W., Hoppe Seyler's Z. Physiol. Chem.237, 8 (1935).
Plieninger H., Lichtenwald H., Hoppe Seyler's Z. Physiol. Chem.273, 206 (1942);Plieninger H., Decker P., Ann. Chem.598, 198 (1956).
Nomenclature of Tetrapyrroles: Pure Appl. Chem.51, 2251 (1979).
Rules for the Nomenclature of Org. Chem.—Stereochemistry: Pure Appl. Chem.45, 13 (1976).
Falk H.,Gergely S.,Grubmayr K.,Hofer D., Ann. Chem.1977, 565. Für einen Überblick über die Struktur von Bilatrienen im kristallinen Zustand siehe:Sheldrick W. S., Isr. J. Chem.23, 155 (1983).
Falk H., Grubmayr K., Magauer K., Müller N., Zrunek U., Isr. J. Chem.23, 187 (1983).
Falk H., Müller N., Org. Magnet. Res.23, 353 (1985).
Falk H., Grubmayr K., Müller N., Vormayr G., Monatsh. Chem.116, 53 (1985).
Falk H., Grubmayr K., Haslinger E., Schlederer T., Thirring K., Monatsh. Chem.109, 1451 (1978).
Gossauer A.,Blacha-Puller M.,Zeisberg R.,Wray V., Ann. Chem.1981, 342.
Falk H., Grubmayr K., Kapl G., Müller N., Zrunek U., Monatsh. Chem.114, 753 (1983).
Falk H., Haslinger E., Schlederer T., Monatsh. Chem.110, 1287 (1979).
Falk H., Müller N., Tetrahedron39, 1875 (1983).
Falk H., Höllbacher G., Monatsh. Chem.109, 1429 (1978).
Edinger J., Falk H., Jungwirth W., Müller N., Zrunek U., Monatsh. Chem.115, 1081 (1984).
Dobeneck H., Graf W., Ettel W., Hoppe Seyler's Z. Physiol. Chem.329, 168 (1962); dafür wurde 3,4-Dimethylpyrrol24 einerseits formyliert [Ofner S., Diss. ETH Nr. 6939,1981, 129; 97% d. Th.], andererseits zu 3,4-Dimethyl-3-pyrrolin-2-on oxidiert (66% d. Th.) [Atkinson J. H., Atkinson R. S., Johnson A. W., J. Chem. Soc.1964, 5999] und anschließend in Analogie zur Vorschrift [Plieninger H., Decker M., Ann. Chem.598, 198 (1956)] kondensiert (91% d. Th.).
Fischer H., Höfelmann H., Amn. Chem.533, 216 (1938). Da diese Synthese, wie auch jene von1 22, vom gut zugänglichen24 3,4-Dimethylpyrrol ausgeht, ist dieses damit die einzige pyrrolische Vorstufe für die Synthese von3! Durch Einsatz derVilsmeier-Formylierung anstelle der vonFischer beschriebenen, erzielt man ausgehend von 3,4-Dimethylpyrrol eine Gesamtausbeute an2 von 76%. Die Synthese von2 wurde kürzlich auch ausgehend vontert-Butyl-3,4,5-trimethyl-pyrrol-2-carboxylat in einer Gesamtausbeute von etwa 10% bescrieben25. Es sei erwähnt, daß wir in nicht optimierten Ansätzen2 ineinem Schritt durch Diformylieren von 3,4-Dimethylpyrrol mit Triethyl-orthoformiat/Trifluoressigsäure in Ausbeuten um 13% erhalten konnten.
Ichimura K., Ichikawa S., Imamura K., Bull. Chem. Soc. Jap.49, 115 (1976).
Battersby A. R.,Fookes S. J. R.,Snow R. J., Chem. Soc., Perkin Trans.I,1984, 2733.
Author information
Authors and Affiliations
Additional information
Herrn Prof. Dr.O. Hromatka zum 80. Geburtstag gewidmet.
Rights and permissions
About this article
Cite this article
Falk, H., Flödl, H. Beiträge zur Chemie der Pyrrolpigmente; 64. Mitt.. Monatsh Chem 116, 1177–1187 (1985). https://doi.org/10.1007/BF00811251
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00811251