Summary
After withdrawal of 400 ml whole blood and subsequent infusion of 500 ml of a colloidal plasma substituent, the intravascular and renal colloid elimination was investigated in 40 test subjects. The individual colloidal solutions could no longer be demonstrated in the intravascular space after the following times: 10% hydroxyethyl starch 200/0.5 (anthrone method) after six weeks, 10% dextran 40 (anthrone method) after two weeks, 6% hydroxyethyl starch 200/0.5 (anthrone method) after four weeks and 5.5% oxypolygelatine (hydroxyproline method) after two days.
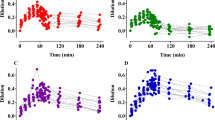
Colloidal plasma substitutes are polydisperse solutions with various molecular weights and degree of hydroxyethylation and therefore, also have a large number of different elimination constants. With repeated application, the intravascular colloid concentration shifts in favour of the molecules with a longer half life which are difficult to eliminate. The elimination of the clinically employed dextran 40 and oxypolygelatine solution could be best described with an open two-compartment model. As a result of its greater heterogeneity, the elimination of the moderately high molecular weight hydroxyethyl starch 200/0.5 could only be characterized approximately even assuming three elimination constants. In the first four days, the hydroxyethyl starch 200/0.5 was more rapidly eliminated compared to dextran 40. However, subsequently a very much lower elimination from the intravascular space was found for about 3% of the administered hydroxyethyl starch 200/0.5. Oxypolygelatine was eliminated especially rapidly. Accordingly, the greatest renal clearance was found for oxypolygelatine, which showed a close relation to the molecular weight. On the other hand, a rapid elimination simultaneously is followed by a correspondingly lower volume effect.
Zusammenfassung
Nach Entzug von 400 ml Vollblut und anschließender Infusion von 500 ml eines kolloidalen Plasmaersatzmittels wurde bei 40 Probanden die intravasale und renale Kolloidelimination untersucht. Die einzelnen kolloidalen Lösungen waren nach folgenden Zeiträumen nicht mehr im Intravasalraum nachweisbar: 10% Hydroxyäthylstärke 200/0,5 (Anthron-Methode) nach 6 Wochen, 10% Dextran 40 (Anthron-Methode) nach 2 Wochen, 6% Hydroxyäthylstärke 200/0,5 (Anthron-Methode) nach 4 Wochen und 5,5% Oxypolygelatine (Hydroxyprolin-Methode) nach-2 Tagen.
Kolloidale Plasmaersatzmittel stellen polydisperse Lösungen mit unterschiedlichem Molekulargewicht und Hydroxyäthylierungsgrad und deshalb auch mit einer Vielzahl unterschiedlicher Eliminationskonstanten dar. Bei wiederholter Applikation verschiebt sich die intravasale Kolloidkonzentration zu Gunsten der schwer eliminierbaren Moleküle mit längerer Halbwertzeit. Die Elimination der klinisch eingesetzten Dextran 40- und Oxypolygelatine-Lösung ließ sich am besten mit einem offenen 2-Kompartiment-Modell beschreiben. Die Elimination der mittelmolekularen Hydroxyäthylstärke 200/0,5 war als Ausdruck ihrer größeren Heterogenität auch unter Annahme von drei Eliminationskonstanten nur näherungsweise zu charakterisieren. In den ersten 4 Tagen wurde die Hydroxyäthylstärke 200/0,5 im Vergleich zu Dextran 40 rascher eliminiert. Anschließend aber fand sich für ca. 3% der zugeführten Hydroxyäthylstärke 200/0,5 eine wesentlich langsamere Elimination aus dem Intravasalraum. Besonders schnell wurde Oxypolygelatine ausgeschieden. Dementsprechend fand sich für Oxypolygelatine die größte renale Clearance, die eine enge Beziehung zum Molekulargewicht zeigte. Andererseits bedeutet eine rasche Elimination gleichzeitig eine entsprechend geringere Volumenwirkung.
Similar content being viewed by others
Literatur
Åberg B, Bloom WL, Hannson E (1961) Gastro-intestinal excretion of dextran C14. Acta Physiol Scand 52:188
Ammon R (1963) Das Vorkommen von Dextranase im menschlichen Gewebe. Enzymologia 25:245
Arturson G, Granath K, Thorèn L, Wallenius G (1964) The renal excretion of low molecular weight dextran. Acta Chir Scand 127:543
Arturson G, Wallenius G (1964) The renal clearance of dextran of different molecular sizes in normal humans. Scand J Clin Lab 16:81
Boon JC, Jesch F, Ring J, Messmer K (1976) Intravascular persistence of hydroxyethyl starch in man. Eur Surg Res 8:497
Ebert KH, Schenk G, Scholz R (1968) Untersuchungen über das Schicksal von Dextran im Organismus von Meerschweinchen. Z Klin Chem Klin Biochem 6:435
Förster H, Wicarkzyk C, Dudziak R (1981) Bestimmung der Plasmaelimination von Hydroxyaethylstärke und von Dextran mittels verbesserter analytischer Methodik. Infusionstherapie 2:88
Gabler G (1961) Über Struktur- und Gestaltverwandlung der Mitochondrien. II. Desintegration und Reorganisation des Chondrioms bei Speicherung und Abbau makromolekularer Stoffe (Dextran). Z Ges Exp Med 134:461
Goldberg M, Crane RD, Popper H (1947) Effect of intravenous administration of dextran, a macromolecular carbohydrate, in animals. Am J Clin Pathol 17:939
Griem W, Czok G, Lang K (1964) Histologische und physiologische Untersuchungen an Ratten nach Verabreichung des Plasmaexpanders Gelifundol. Anaesthesist 13:321
Kief H, Engelbart K (1966) Reabsorptive Vacuolisation der gewundenen Nierenhauptstücke (sog, osmotische Nephrose). Frankf Z Pathol 75:53
Köhler H (1979) Einfluß der Nierenfunktion auf die Elimination und Wirkung von kolloidalen Plasmaersatzmitteln. Fortschr Med 97:1809
Köhler H (1979) Unerwünschte Wirkungen von Dextran. Inn Med 6:63
Köhler H, Kirch W, Fuchs P, Stalder K, Distler A (1978) Elimination of hexamethylene diisocyanate cross-linked polypeptides in patients with normal or impaired renal function. Eur J Clin Pharmacol 14:405
Köhler H, Kirch W, Höffler D, Koeppe P (1974) Pharmakokinetik und Dosierung von Dextran 40 in Abhängigkeit von der Nierenfunktion. Klin Wochenschr 52:1111
Köhler H, Kirch W, Horstmann HJ (1977) Die Bildung hochmolekularer Komplexe aus Serumamylase und kolloidalen Plasmaersatzmitteln. Anaesthesist 26:623
Köhler H, Kirch W, Vogt J, Höffler D (1977) Pharmakokinetik von Hydroxyäthylstärke bei Niereninsuffizienz. Verh Dtsch Ges Inn Med 83:1676
Köhler H, Kireh W, Weihrauch TR, Prellwitz W, Horstmann HJ (1977) Macroamylasaemia after treatment with hydroxyethyl starch. Eur J Clin Invest 7:205
Köhler H, Weihrauch TR, Fiegel P, Kirch W, Höffler D (1975) Dosierung und Elimination von Dextran 40 bei Hämodialysepatienten. Klin Wochenschr 53:523
Köhler H, Zschiedrich H, Clasen R, Linfante A, Gamm H (1981) Blutvolumen, kolloidosmotischer Druck und Nierenfunktion von Probanden nach Infusion mittelmolekularer 10% Hydroxyäthylstärke 200/0,5 und 10% Dextran 40. Anaesthesist (im Druck)
Kuhn N (1973) Experimentelle Untersuchungen über den intravasalen Volumeneffekt, die Verweildauer und Ausscheidung von inaktiver und radioaktiver (Jod131)-Gelatine. Inaugural-Diss., Berlin
Lindblad G, Falk J (1976) Konzentrationsverlauf von Hydroxyäthylstärke und Dextran in Serum und Lebergewebe von Kaninchen und die histopathologischen Folgen der Speicherung von Hydroxyäthylstärke. Infusionstherapie 3:301
Lindner J (1964) Morphologische Untersuchungen über das Schicksal von Plasmaexpandern. In: Horatz K, Frey R (eds) Schock und Plasmaexpander. Springer, Berlin Heidelberg New York, pp 23–64
Messmer K, Jesch F (1978) Volumenersatz und Hämodilution durch Hydroxyäthylstärke. Infusionstherapie 5:169
Metcalf W, Papadopoulos A, Tufaro R, Barth A (1970) A clinical physiologic study of hydroxyethyl starch. Surg Gynecol Obstet 131:255
Mishler JM, Beez M (1979) Die mathematische Beschreibung der intravasalen Ausscheidung von HÄS nach wiederholten Infusionen beim Menschen. Infusionstherapie 6:119
Richterich R (1971) Klinische Chemie. 3. Aufl. Karger, Basel, pp 261–262, 444–446
Stegemann H (1958) Mikrobestimmung von Hydroxyprolin mit Chloramin-T und p-Dimethylaminobenzaldehyd. Hoppe-Seylers Z Physiol Chem 311:41
Stegemann H, Stalder K (1967) Determination of hydroxyproline. Clin Chim Acta 18:267
Thompson WL, Britton JJ, Walton RP (1962) Persistence of starch derivatives und dextran when infused after hemorrhage. J Pharmacol Exp Therap 136:125
Thompson WL, Fukushima R, Rutherford RB, Walton RP (1970) Intravascular persistence, tissue storage, and excretion of hydroxyethyl starch. Surg Gynecol Obstet 131:965
Wallenius G (1954) Renal clearance of dextran as a measure of glomerular permeability. Acta Soc Med Upps [Suppl] 4:1
Yoshida M, Jamashita T, Matsuo I, Kishikawa T (1973) Enzymic degradation of hydroxyethyl starch. Stärke 25:373
Zekorn D (1969) Intravascular retention, dispersal, excretion and break-down of gelatin plasma substitutes. In: Modified gelatins as plasma substitutes. Bibl Haematol 33:131–140
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Köhler, H., Zschiedrich, H., Linfante, A. et al. Die Elimination von Hydroxyäthylstärke 200/0,5, Dextran 40 und Oxypolygelatine. Klin Wochenschr 60, 293–301 (1982). https://doi.org/10.1007/BF01716806
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF01716806