Abstract
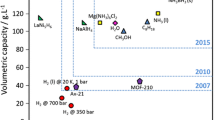
The kinetics of decomposition of hydrogen peroxide have been studied on mixed Fe(III)−Al(III) hydroxide and oxide catalysts. While iron hydroxide possesses considerable catalytic activity, aluminium hydroxide has very little activity. The rate of decomposition on mixed hydroxides increases with increasing concentration of aluminium hydroxide up to about 1.5 mol% and decreases thereafter. The mixed oxides possess negligible activity compared to the corresponding hydroxides. The energy of activation, as calculated from the Arrhenius equation, is 10.1 kcal/mol for sample S4, containing 1.52 mol% of alumina. The rate of decomposition of S4 increases with increasing pH up to 6.8 and decreases thereafter. The rate is first order in all these cases. A suitable mechanism is suggested.
Abstract
кинетика разложения перекиси водорода была исследоаана на катализаторах смешанных окисей и гидроокисей Fe(III)−Al(III). В то время как гидроокись железа обладает значительной катлитической активностью, тидроокись алюминия имеет очень малую активность. Скопость разложения на смешанных, гидроокисях увеличивается с увеличением концентрации окиси алюминия вплоть до 1,5 молярных процентов, а далее уменьшается. Смешанные окиси авладают незначительной активностью по сравнению с соответствующими гидроокисями. Энергия активации, рассчитанная из аррениусовской зависимости, равна 10,1 ккал/моль для образцов S4, содержащих 1,52 молярных процента окиси алюминия. Скорость разложения на S4 увеличивается с увеличением pH вплоть до 6,8, а затем уменьшается. Скорость реакции подчиняется закону первого порядка во всех случаях. Предлагается вероятный механизм.
Similar content being viewed by others
References
C. Berger, Ed.: Handbook of Fuel Cell Technology, p. 147. Prentice-Hall, New Jersey 1968.
A. Krause: Roczn. Chem.,26, 3 (1952).
A. Krause, F. Domka, E. Kukielka, J. Orlikowska: Monatsh.,95, 231 (1963).
A. Krause, H. K. Rasinska: Roczn. Chem.,33, 823 (1959).
A. Krause, F. Domka: Monatsh.,95, 279 (1963).
B. Mani, V. Sitakara Rao: Ind. J. Chem. (in press).
B. Mani, V. Sitakora Rao, H. S. Maiti: J. Mater., Sci. (in press).
B. Mani, V. Sitakara Rao: J. Thermal Analysis (in press).
J. R. Godstein, A. C. C. Tseung: J. Catal.,32, 452 (1974).
N. A. Lange, G. M. Forker: Handbook of Chemistry, p. 1224. McGraw-Hill Book Company, New York 1967.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Mani, B., Mohan, C.R. & Rao, V.S. Kinetics of decomposition of hydrogen peroxide on Fe(III)−Al(III) hydroxide-oxide systems. React Kinet Catal Lett 13, 277–284 (1980). https://doi.org/10.1007/BF02068578
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF02068578