서 언
재료 및 방법
식물재료
항산화 유전자 SOD2 및 NDPK2 집적 형질전환 페튜니아 계통 후대획득
PCR 분석
아황산가스 저항성 검정
RT-qPCR 분석
결과 및 고찰
항산화 유전자 SOD2 및 NDPK2 집적 페튜니아 형질전환체 획득
SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체의 아황산가스 저항성
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체 후대획득
SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체 후대의 아황산가스 저항성 재확인
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환 후대의 광합성 효율 증진 확인
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환 후대의 도입 유전자 발현 확인
서 언
페튜니아는 절화류 중심으로 꽃 소비가 이루어지는 우리나라의 경우 2013년 현재 총 화훼 판매액 (7,656.5억원)의 20.7%를 점유하는 초화류 및 종자·종묘 시장의 6% 정도 점유한다(Ministry of Agriculture, Food and Rural Affairs, 2014). 반면, 1년초 및 정원용 화훼류 중심으로 꽃 소비가 이루어지는 미국의 경우 2010년 현재 총 화훼소비량(3,981,711,000$)의 34.1%를 차지하는 초화 및 화단용 화훼시장의 10%를 차지할 정도로 소비 비중이 적지 않은 화종이다(United States Department of Agriculture, 2011).
페튜니아는 팬지와 더불어 봄부터 늦여름까지 대기오염에 직접 노출되는 도로 및 가로변의 화단용으로 주로 이용되어 대기 오염을 포함한 환경스트레스로 인한 잎의 퇴색 등으로 관상가치가 저하되므로 대기오염 스트레스에 대한 저항성 증진 품종 개 발이 요구되고 있다. 그런데, 교잡육종 기술에 의해 대기오염 스트레스에 대한 저항성 증진 식물을 개발하는 것이 쉽지 않아 벼 등 주곡작물에서 육종의 주요 수단으로 된 형질전환 기술을 이용하여 대기환경오염 저항성 식물체를 개발하고자 하는 연구가 시도되고 있고(Lee et al., 2015; Nakamura et al., 2009; Nian et al., 2014; Su et al., 2015), 최근에는 단독 유전자 도입이 아닌 두 종류 이상의 유전자 집적 방법에 의해 대기환경 오염 스트레스 저항성을 더욱 배가시키고자 하는 노력들도 이루어지고 있 다(Kim et al., 2015; Tseng et al., 2008). 보편적으로 이용되고 있는 유전자 집적 방법에는 2개 이상의 외래 유전자를 한번에 도 입하거나 1개 도입된 형질전환체에 또 다른 종류의 유전자를 연이어 도입하거나1개의 외래 유전자를 도입한 형질전환체간 교 잡에 의해 유전자를 도입되도록 하는 방법 등이 있다(Francois et al., 2002). 본 연구팀에서는 이전의 연구결과에서 내환경성 페 튜니아 형질전환체를 개발하고자 대장균 유래superoxide dismutase 2(SOD2) 및 애기장대 유래 Nucleoside-diphosphate kinases 2(NDPK2, 이전 연구에서는SN으로 표기 됨) 유전자를 페튜니아 순계 계통 Wongyo A2-36에 각각 도입하여 내염성 형질전환체를 개발한 바 있으며(Lee et al., 2009a), 이후 그들을 세대진전 시킨 후대들간의 교잡을 통해 획득한 교잡세대들이 산화적 스트레스에 대한 저항성이 증진된 것을 확인한 바 있다L(ee et al., 2011).
SOD2는 스트레스에 의해 식물체내에 발생되는 과산화물음이온라디칼 O2-의 불균등화 반응을 촉매하는 효소인 superoxide dismutase 유전자 중 Mn과 결합하여 작용하는 효소 유전자로 애기장대(Gao et al., 2003), 벼(Zhao et al., 2006) 등에 도입된 식 물체가 내염성을 나타내었다고 보고된 바 있다. NDPK2는 진핵생물에서 세포증식, 세포발당 및 세포분화 등에 관여하는 단백 질인 NDPK의 하나로 애기장대에서 항산화 관여 유전자들의 조절 기능을 하는 것으로 보고되었으며, 감자에 도입된 식물체가 산화스트레스에 대한 내성이 증진되었다고 보고된 바 있다T(ang et al., 2004).
이에, 본 연구는 SOD2 및 NDPK2 유전자가 페튜니아 순계 계통에 각각 도입된 형질전환체간 교잡에 의해 SOD2 및 NDPK2 유전자룰 집적시켰을 때 산화스트레스 저항성이 증진된 페튜니아 형질전환 계통 및 그 후대가 아황산가스 저항성도 증진되는 지를 조사하고자 실시하였다.
재료 및 방법
식물재료
본 연구팀의 이전 연구(Lee et al. 2011)에서 사용된 NDPK2-7-1(T2)[이하 N7-1(T2)로 표기]계통과, SOD2-2-1-1-35(T3) 계통의 후대 SOD2-2-1-1-35(T4)[이하 S(T4)로 표기]계통을 NDPK2와 SOD2 유전자 집적 계통을 획득하기 위한 교배모본 으로 사용하였다.
항산화 유전자 SOD2 및 NDPK2 집적 형질전환 페튜니아 계통 후대획득
N7-1(T2)와 S(T4)의 교잡 제1세대는 2009년에 S(T4)와 N7-1(T2)간 상호교배에 의하여, 교잡 2세대는 2010년에 교잡 제1세 대의를 자가수분시킨 후 획득하였다. 종자는 교배 및 자가수분 후 45-50일경 충실도를 기준으로 채종하였다. 채종한 종자는 한 달여 기간의 저온처리 후 파종하였으며, 32공 프러그 트레이 가식 및 화분(직경 15cm)정식 후 국립원예특작과학원 LMO식 물체 격리온실에서 재배하였다.
PCR 분석
SOD2 및 NDPK2 유전자가 집적된 교잡 후대를 선발하기 위해 PCR 분석을 이용하였다. PCR 분석을 위한 교잡 후대의 genomic DNA는 파종 후 87일된 식물체의 어린 잎으로부터 DNeasy plant mini kit(Qiagen, Hilden, Germany)를 이용하여 추 출하였다. 추출한 DNA는 NanoVue(GE, Buckinghamshire, UK)을 이용하여 정량한 후 template DNA로 사용하였다. PCR반 응액 조성은 총 25μL 반응액에 한 후 25-50 ng·L-1의 total genomic DNA, 0.2mM의 dNTPs, 50ng의 SOD2 또는 NDPK2 유 전자 특이 primers, 1× Taq DNA polymerase buffer와 1unit의 Taq DNA polymerase(Takara, Shiga, Japan)을 첨가하였다. SOD2 유전자 특이 primers 염기서열은 (forward; 5'-TAC TGG AGA TGA ATA TGA GC-'3 , reverse; 5'-CAG CAG GCG GCA AAT GAT TA-3')이고, NDPK2 유전자 특이 primers 염기서열은 (forward; 5'-GAG GCT ATT CGG CTA TGA CTG-3', reverse; 5'-ATC GGG AGC GGC GAT ACC GTA-3')이다. PCR 증폭은 icycler(Bio-Rad, CA, USA)를 이용하여 94°C에서 5분간 주형 DNA를 predenaturing시킨 후, 94°C에서 1분간 변성, 55°C에서 1분간 annealing, 72°C에서 2분간 extension을 55회 반복시켰다.
아황산가스 저항성 검정
SOD2 및 NDPK2 유전자가 집적된 교잡 후대의 아황산가스 저항성 정도를 측정하기 위한 아황산가스 처리는 Lee et al.(2009b)의 방법을 일부 변경하여 수행하였다. 분 정식 후 100일된 SOD2 및 NDPK2 유전자 집적 식물체를 지제부까지 비닐 로 감싸 투명 아크릴판으로 제작한 120cm3 밀폐 챔버 바닥에 둔 후 아황산가스를 처리하였다. 아황산가스는 충전압력이 35°C 에서 135kg·cm-3으로 1,000ppm농도를 N2로 밸런스 한 후 간이측정기(Gastec GV-100s, Kanagawa, Japan)를 사용하여 30ppm 4시간 처리하였다. 챔버 내 환경은 HOBO(Onset Computer, Massachusetts, USA)를 챔버 바닥에 놓고 조사하였으며, 평균 온도는 26.8 ± 0.6°C 및 습도는 59.7 ± 13.0%이었다. 처리 후 지제부까지 감쌌던 비닐을 제거하고 유리온실에서 관리하 면서 피해 증상을 육안으로 관찰하였다. 교잡 제 1 세대 실험의 피해율은 2명의 연구원이 처리 식물체 잎 개개의 전체 면적 대 비 피해 받은 부위 비율을 5% 간격으로 0%에서 100%로 구분하여 조사한 후 다음 식에 의해 계산하였다. Visible injury(VI, 피 해율) = [(0% 피해 잎 수 × 0.0) + (5% 피해 잎 수 × 0.05) + (10% 피해 잎 수×0.1) +·……+ (100% 피해 잎 수 × 1.0)]/전체 잎 수/2. 반면, 아황산가스 저항성이 증진된 교잡 제1세대의 아황산가스 저항성 증진 특성의 재현 확인 목적이었던 교잡 제 2 세대 실험의 피해율은 3명의 연구원이 각각 아황산 가스 처리 식물체 전체에 대한 피해 정도를 비율로 조사한 후 평균치로 계산하였 다. 또한, 광합성측정장치 Li-6400(LI-COR Biosciences, Lincoln, NE, USA)를 이용하여 아황산가스 가시적 피해가 가장 적 은 잎과 가장 큰 잎의 광합성 능력을 조사하였다. 형질전환 계통과 대조 비형질전환체간 아황산가스 피해율과 광합성능력에 대 한 통계적 유의성은 SAS 9.2(sas Inst. Inc., Cary, NC, USA) 프로그램을 이용하여 DUNCAN 다중검정하였다.
RT-qPCR 분석
RNeasy Mini Plant Kit(Qiagen, Hilden, Germany)를 이용하여 잎으로부터 total RNA를 추출하고, total RNA 추출액에 혼 입된 genomic DNA을 제거하기 위해 최종 반응액 10μL에 1μg의 total RNA, 1x RQ1 DNase Reaction Buffer와 1unit의 RQ1 RNase-Free DNase(Promega, WI, USA)을 혼합하여 37°C에서 1시간동안 처리하였다. 또한 gDNA의 제거를 확인하기 위해 1μL의 DNase를 처리한 total RNA, 1x Buffer, 0.2mM dNTP, 각 0.2μM ACTIN 프라이머(Table 1), 1.25unit Ex-taq(TaKaRa, Shiga, Japan)을 혼합하여 10μL의 반응액을 조성하고, 94°C에서 2분간 initial-denaturation을 수행 후, denaturation 94°C-30 초, annealing 60°C-30초, extension 72°C-30초 과정을 40반복, final-extension 72°C-2분으로 standard PCR을 완료하였다. PCR반응이 완료된 PCR산물들은 1% agarose gel에서 전기영동을 수행하여 증폭된 PCR산물이 없음을 확인하였다. gDNA를 제거한 total RNA와 PrimeScript 1ststrand cDNA Synthesis Kit(TaKaRa, Shiga, Japan)를 이용하여 매뉴얼의 지시에 따라 20μL의 cDNA를 합성하였다. 그리고 1μL의 합성된 cDNA와 ACTIN 프라이머를 이용하여 상위의 PCR조건으로 cDNA합성 여부를 확인한 다음, 각 cDNA를 10배 희석시켜 Reverse Transcription-quantitative PCR(RT-qPCR)에 이용하였다. RTqPCR 분석을 위하여 기존에 보고된 서열을 기반으로 프라이머를 다자인하고(Table 1) 합성하여 발현분석에 이용하였다. RT-qPCR은 최종 반응액 20μL에 1x SYBR premix EX taq II(TaKaRa, Shiga, Japan), 각 0.4μM 프라이머, 1x ROX reference Dye, 1μL의 cDNA를 혼합하였다. 그 반응액을 Rotor-gene Q cycler(Qiagen, Hilden, Germany)의 3step으로 RT-qPCR을 수 행하였으며, 그 반응조건은 95°C에서 10분간 initial denaturation을 수행 후, denaturation 95°C-5초, annealing 60°C-20초, extension 72°C-30초 과정을 40반복하였다. 샘플마다 threshold를 0.05로 설정하여 Ct값을 산출하고 housekeeping 유전자 ACTIN의 Ct값으로 normalization하였다. 상대정량값의 계산은 ΔΔCt법을 이용하였고, 식물 3반복의 상대정량 값으로 평균과 표준오차를 계산하였다.
결과 및 고찰
항산화 유전자 SOD2 및 NDPK2 집적 페튜니아 형질전환체 획득
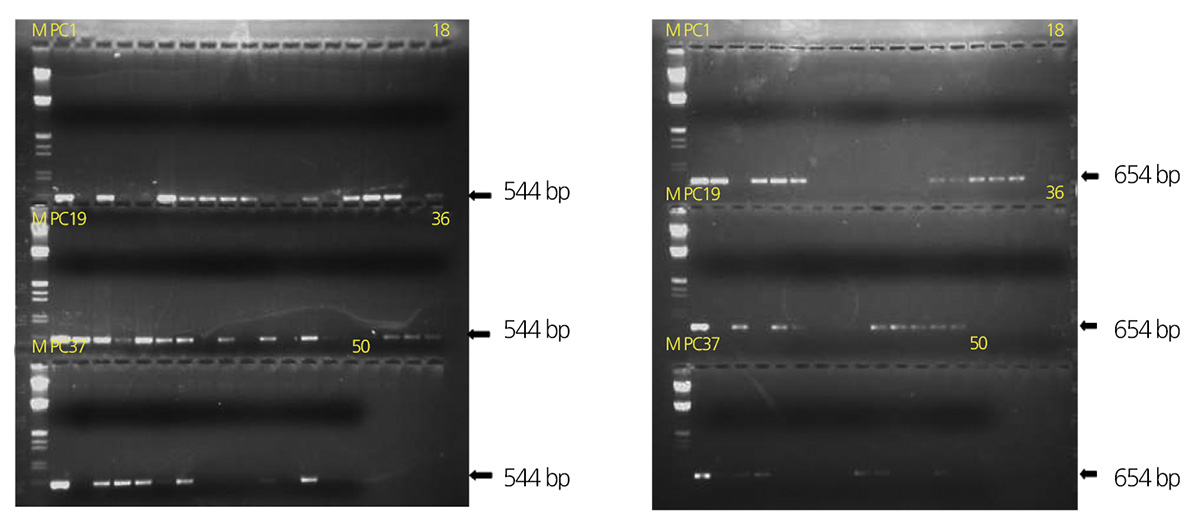
다수 유전자의 집적을 통해 비생물적 또는 생물적 스트레스에 대한 식물의 저항성이나 영양적 가치를 배가시키고자 하는 노 력들이 이루어지고 있고, Fracois et al.(2002)과 Halpin(2005)에 의해 유전자 집적 방법과 그 간의 유전자 집적 연구들에 대한 체계적인 정리가 이루어진 바 있다. 다수 유전자 집적 방법에는 단독 유전자가 도입된 형질전환체간 교잡을 통한 방법, 순차적 으로 형질전환을 반복하여 다수 유전자를 한 식물체에 도입하는 방법, 여러 유전자를 한번의 형질전환을 통해 도입하는 방법 등이 있다. 화훼류 중에서는 petunia에서 비생물적스트레스 스트레스 저항성을 증진시키고자 교잡방법이 이용된 바 있고(Lee et al., 2011), Phalaenopsis에서 병 저항성을 증진시키고자 순차적 형질전환 반복방법이 이용된 바 있다(Chan et al., 2005). 본 연구에서는 대기환경오염원에 대한 저항성을 증진시키고자 비생물적스트레스 저항성 유전자로 널리 알려진 SOD2와 NDPK2 유전자가 각각 도입된 SOD2 형질전환 T4계통과 NDPK2 형질전환 T2계통간 상호교잡을 실시하였고, 획득한 종자를 파종, 화분 정식 후 양친의 유전자인 SOD2와 NDPK2가 모두 집적된 식물체를 선발하기 위해 PCR 분석을 실시하였다. 그 결과, SOD2 형질전환체를 모본으로 하고 NDPK2형질전환체를 부본으로 한 [S(T4)×N7-1(T2)](TF1) 교잡 제1세대의 양친의 유전자 집적 개체의 획득율은 30.0%이었으나, NDPK2형질전환체를 모본으로 하고 SOD2형질전환체를 부본으로 한 [N7-1(T2)×S(T4)] (TF1) 교잡 제1세대의 경우는 62.5%로, NDPK2가 모본이고 SOD2가 부본으로 교잡되었을 때 양친 유전자의 후대 집적율이 2 배 정도 더 높았다(Table 2).
SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체의 아황산가스 저항성
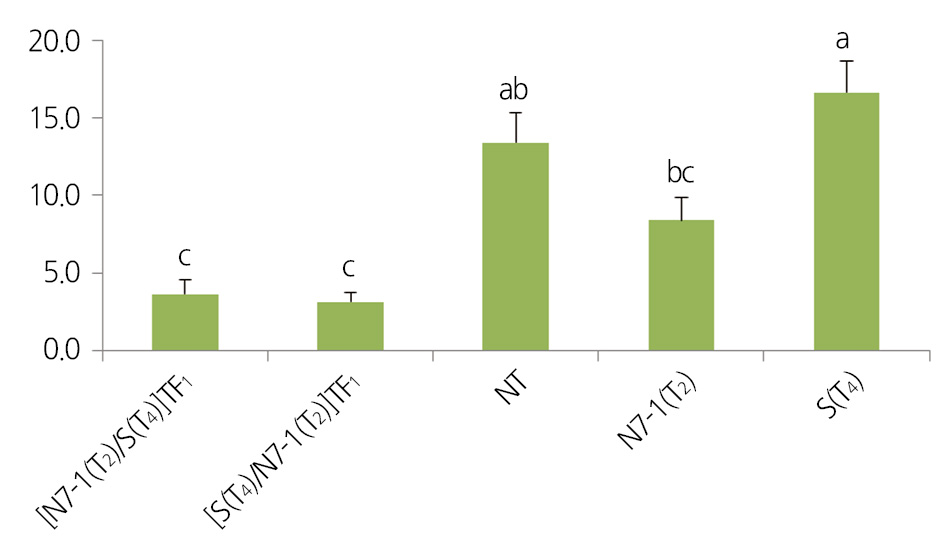
PCR 분석에 의해 SOD2 및 NDPK2 유전자의 집적이 확인된 [S(T4)×N7-1(T2)](TF1) 및 [N7-1(T2)×S(T4)](TF1) 교잡 제1 세대를 아황산가스 30ppm에 4시간 노출시키고, 5일 후 평균 피해율을 육안으로 조사한 결과, SOD2 및 NDPK2 유전자가 각 각 도입된 형질전환체 N7-1(T2)와 S(T4)는 피해율이 각각 16.6% 및 8.4%인 반면 SOD2 및 NDPK2가 집적된 [S(T4)×N7- 1(T2)](TF1) 및 [N7-1(T2)×S(T4)](TF1) 교잡 제1세대 식물체들의 피해율은 각각 3.7% 및 3.2%로 SOD2 및 NDPK2 유전자가 단독 도입된 형질전환체에 비해 두 유전자가 집적되었을 때 피해율이 2.6-5.1배 낮았다. 이 결과로 볼 때 SOD2 및 NDPK2 유 전자 집적 개체는 두 유전자 단독 도입된 형질전환체에 비해 아황산가스 저항성이 증대되는 것을 확인할 수 있었다(Fig. 1.). 비 생물적스트레스 저항성 증진 유전자 집적을 통해 아황산 가스 저항성 형질전환체 획득에 관한 연구는 Tseng et al.(2008)에 의 해서도 보고된 바 있다. 그들은 본 연구에서 사용한 대장균 유래의 superoxide dismutase 유전자 SOD와 catalase 유전자 CAT 를 각각 삽입하고 있는 아그로박테리움과의 혼합 접종을 통해 SOD 와 CAT유전자가 동시에 도입된 배추 형질전환체를 획득 후, 자가 채종에 의해 세대진전시킨 T1계통 중 SOD나 CAT 유전자 단독 혹은 집적 계통을 선발하여 아항산 가스에 노출하여 피 해율을 조사한 결과 본 연구에서와 같이 SOD나 CAT 유전자 단독보다는 두 유전자가 집적되었을 때 아항산가스 피해율이 39-55% 낮았다고 보고하였다.
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체 후대획득
SOD2와 NDPK2 유전자가 집적된 교잡 제 1세대의 아황산가스 처리 실험 후 아황산가스 저항성이 증진된 SOD2와 NDPK2 유전자 집적 교잡 제1세대의 아황산가스 저항성이 후대에서도 발현되는지를 확인하기 위해서 SOD2와 NDPK2 유전자가 집 적되고 아황산가스 저항성이 증진되었던 [S(T4)×N7-1(T2)](TF1) 및 [N7-1(T2)×S(T4)](TF1) 교잡 제1세대를 자가수분 한 후 획득한 교잡 제2세대를 PCR분석 한 결과, SOD2형질전환체를 모본으로 하고 NDPK2형질전환체를 부본으로 한 [S(T4)×N7-1(T2)](TF2) 교잡 제2세대의 양친 유전자 집적 개체 획득율은 39.3%이었으나, NDPK2형질전환체를 모본으로 하고 SOD2형질 전환체를 부본으로 한 [N7-1(T2)×S(T4)](TF1) 교잡 제2세대의 경우는 63.6%로, 교잡 제1세대 와 마찬가지로 NDPK2가 모본 이고 SOD2가 부본으로 교잡되었을 때 양친 유전자의 후대 집적율이2 배 정도 더 높았다(Fig. 2 and Table 2).
SOD2와 NDPK2 유전자 집적 페튜니아 형질전환체 후대의 아황산가스 저항성 재확인
SOD2 및 NDPK2 유전자 집적 식물체의 아황산가스 저항성을 재확인하기 위하여 아황산가스 저항성 SOD2 및 NDPK2 유 전자 집적 형질전환체를 자가수분 후 획득된 [S(T4)×N7-1(T2)](TF2) 및 [N7-1(T2)×S(T4)](TF2) 개체들 중 PCR분석에 의해 SOD2 및 NDPK2 유전자의 집적이 확인된 식물체들을 아황산가스 30ppm에 노출시키고 5일 후 평균 피해율을 육안으로 조 사한 결과, SOD2 및 NDPK2 유전자 집적 식물체 후대에서도 아황산가스저항성 특성이 안정적으로 발현함을 확인하였다 (Fig. 3).
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환 후대의 광합성 효율 증진 확인
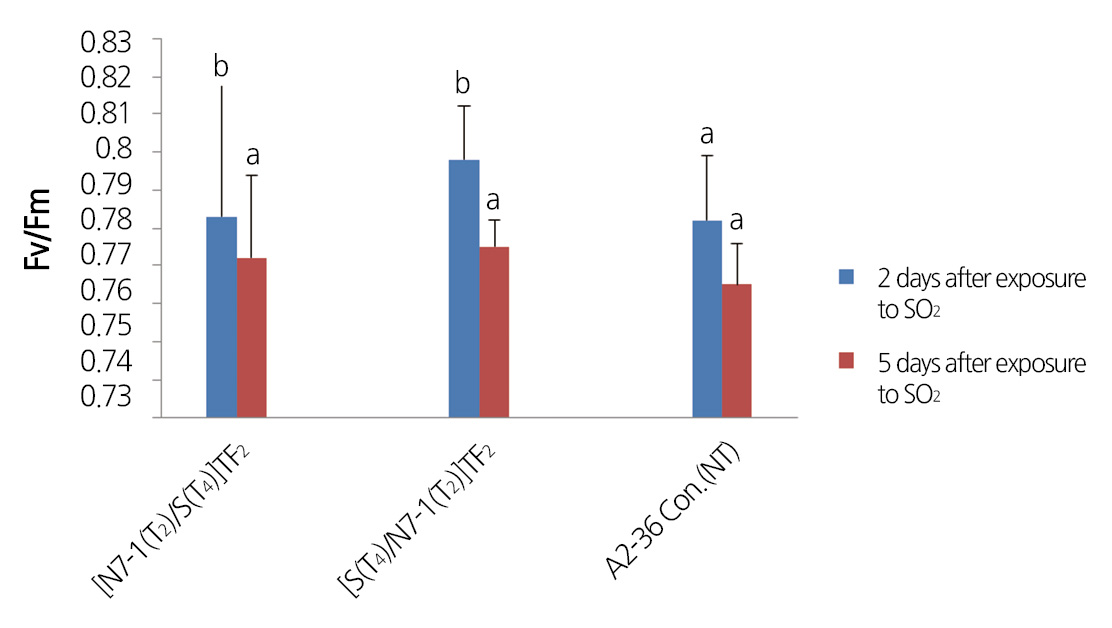
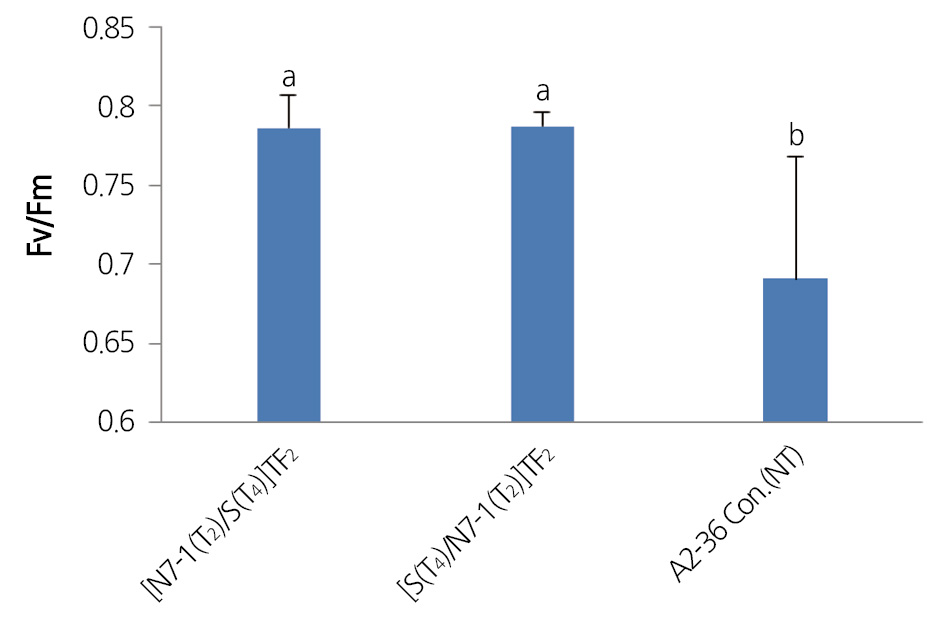
식물 광합성 기작 시스템II(PSII) 효율 조사 결과에서도 SOD2 및 NDPK2 유전자 집적 식물체 후대들이 비형질전환체에 비 하여 아황산가스에 대한 저항성이 증진되어 아황산가스에 대한 스트레스를 덜 받고 있음을 확인할 수 있었다. 아황산가스 처 리 받은 [S(T4)×N7-1(T2)](TF2) 및 [N7-1(T2)×S(T4)](TF2) 개체들 중 아황산가스 피해가 가장 적은 잎과 가장 많은 잎의 식물 광합성 기작 시스템II(PSII) 효율 조사 결과, 아황산 가스 피해가 가장 적은 잎의 경우, 아황산 처리 후 2일 5일 Fv/Fm이 비형질 전환체는 평균 0.782인데 [S(T4)×N7-1(T2)](TF2) 와 [N7-1(T2)×S(T4)](TF2) 식물체는 각각 평균 0.798과 0.783이었으며, 아 황산 가스 피해가 가장 많은 잎의 경우, 아황산 처리 후 6일 Fv/Fm이 비형질전환체는 평균 0.691인데 [S(T4)×N7-1(T2)](TF2) 와 [N7-1(T2)×S(T4)](TF2) 식물체는 각각 평균 0.787과 0.786이었다. 식물이 스트레스에 노출되었을 때 잎의 Fv/Fm이 0.83정 도 보다 낮을수록 식물이 스트레스 노출 정도가 심함을 나타내므로(Bjorkman and Demmig, 1987), SOD2 및 NDPK2 유전자 의 집적 식물체 후대들이 비형질전환체에 비하여 스트레스에 대한 저항성이 증진되어 스트레스를 덜 받고 있음을 의미한다고 할 수 있다(Figs. 4 and 5).
아황산가스 저항성 증진 SOD2와 NDPK2 유전자 집적 페튜니아 형질전환 후대의 도입 유전자 발현 확인
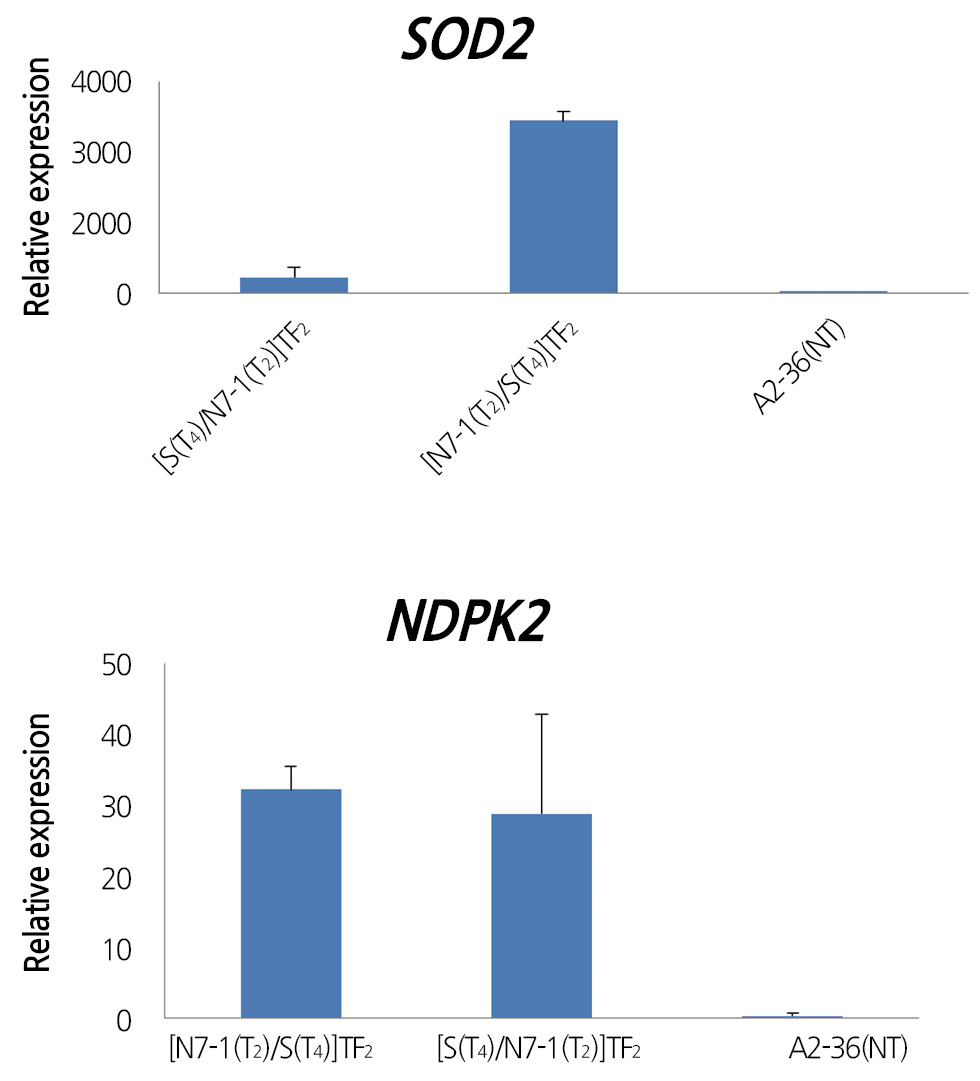
RT-qPCR 분석에 의해 SOD2와 NDPK2 유전자 집적 후 아황산 가스 저항성 2계통, [N7-1(T2)×S(T4)](TF2)와 [S(T4)×N7- 1(T2)](TF2), 식물체에서의 SOD2와 NDPK2 유전자 발현을 조사한 결과, 2계통 모두 NDPK2 유전자의 발현은 비형질전환체 보다 약 30배가 증가하였고, SOD2 유전자의 발현의 경우 [N7-1(T2)×S(T4)](TF2)계통은 비형질전환체 보다 약 3000배 이상 높았으며, [S(T4)×N7-1(T2)](TF2) 계통은 비형질전환체 보다 약 200배 이상 높아, 2계통의 아황산가스 저항성 특성이 유전자 집적에 의한 효과임을 알 수 있었다(Fig. 6).
이상의 연구는 교잡방법을 이용하여 획득된 비생물적 스트레스 저항성 유전자 SOD2 및 NDPK2 집적에 의해 아황산 가스 저항성이 증진될 수 있는 가능성을 제시하였다고 할 수 있다, 본 연구를 통해 획득된 아황산 가스 저항성 증진 페튜니아 형질전 환 계통 [N7-1(T2)×S(T4)](TF2)와 [S(T4)×N7-1(T2)](TF2)는 아황산 가스를 포함한 대기환경 오염 저항성 페튜니아 품종 개 발을 위하여 유용하게 활용될 수 있을 것으로 기대한다.